 |
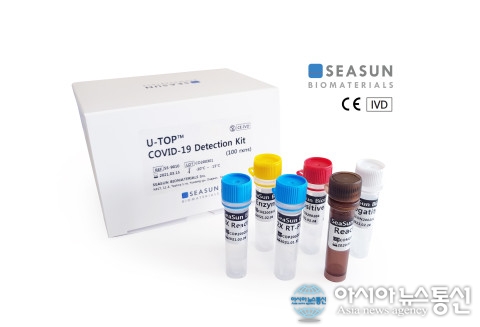
| 코로나 진단키트 FDA 승인, 긴급사용신청 업체 어디? (사진-시선바이오 제공) |
[아시아뉴스통신=전우용 기자]코로나 진단키트 관련기업들이 연이어 美 FDA에 승인을 신청하면서 관심이 쏠리고 있다.
시선바이오머티리얼스는 코로나 19 진단 제품 ‘U-TOP COVID-19 Detection Kit“에 대해 식품의약품안전처로부터 수출 허가를 획득했다고 2일 밝혔다.
지난 2월 유럽 CE-IVD 인증을 시작으로 유럽·중동·동남아 등에 수출을 진행 중으로 이번 수출 허가로 전세계로 수출을 확대했으며, 지난달 25일엔 미국 식품의약국(FDA)에 긴급사용승인 신청을 완료한 상태다.
관계자는 “해당 제품은 세계보건기구(WHO)가 코로나 19 진단에 가장 정확한 지표로 선정한 N 유전자와 RdRp 유전자를 타겟으로 하며, 타겟 검출력이 뛰어난 인공 DNA (PNA)를 이용해 미량의 바이러스를 가진 감염 환자도 조기에 선별 가능하다”고 말했다.
이어 “위양성 및 위음성을 줄여 재검 발생율을 최소화하면서 99% 이상의 정확도를 보인다. Real-time PCR결과는 1시간 30분내 확인 가능하며, 전용 분석 프로그램을 통해 결과 확인 및 보고서 도출을 간편화 했다. 정확성, 신속성, 효율성, 편리성을 모두 갖췄다”고 밝혔다.
또 다른 업체인 엑세스바이오(950130)는 코로나19 분자진단키트의 미국식품의약국(FDA) 긴급사용승인(Emergency Use Authorizations)을 신청했다고 1일 밝혔다.
엑세스바이오는 현재 미국 5곳의 주정부와 상담을 시작했다. 긴급사용승인이 나올 경우, 진단제품을 비롯한 각종 의료기기의 시장 진출이 가능해진다. 또 엑세스바이오와 자회사 웰스바이오는 코로나19 분자진단키트의 전세계 보급을 위해 우리들제약과 공동판매에 나서고 있다.
웰스바이오의 코로나19 분자진단키트는 지난달 3일 유럽인증(CE)을 했으며, 같은달 18일 식품의약품안전처(MFDS)로부터 수출용 허가를 획득했다.
ananewsent@gmail.com